Luis A. Pérez de LLano
Sección de Neumoloxía
Hospital Xeral
Lugo
1. INTRODUCCIÓN.
El tromboembolismo pulmonar (TP) es el enclavamiento en las arterias pulmonares de uno o más trombos procedentes del territorio venoso. El 90% de estos trombos se originan en las venas de las extremidades inferiores, siendo las venas ilíacas y femorales las de mayor capacidad embolígena. Otras posibles localizaciones son las venas del territorio sural (por debajo de la rodilla), venas pélvicas, cava inferior, corazón derecho y territorio axilo-subclavio. El que el TP sea una complicación de un proceso originado fuera del pulmón, conlleva que las cuestiones diagnóstica, preventiva y terapéutica no puedan ser abordadas excluyendo la trombosis venosa profunda (TVP). Esta interrelación entre TVP y TP es el motivo de que en la actualidad sean considerados como una sola entidad y se hable de enfermedad tromboembólica venosa (ETV).
La ETV es la causa más frecuente de mortalidad hospitalaria susceptible de ser prevenida. En los Estados Unidos se ha estimado que es la causa directa de muerte de 100.000 personas/año y que puede contribuir a ella en otros 100. 000 casos anuales. Sin embargo, se trata de una enfermedad clínicamente silente como demuestra el hecho de que, en pacientes cuya autopsia había constatado la presencia de un TP, éste no había sido previamente sospechado en el 70-80% de los casos. La elevada morbimortalidad generada por la ETV junto con la dificultad diagnóstica que ofrece, constituyen un permanente acicate para los clínicos en general, y para quienes se desenvuelven en el entorno hospitalario en particular.
1. FISIOPATOLOGÍA.
1.1. Trombogénesis.
La historia de la ETV comienza con la formación de un trombo venoso. Existen tres factores que favorecen la trombogénesis venosa: estasis o enlentecimiento del flujo sanguíneo, daño de la pared del vaso y alteraciones en el mecanismo de coagulación. Por lo tanto, todas las causas predisponentes (tabla 1) actúan sobre uno o varios de estos factores.
TABLA 1.– Factores predisponentes de ETV.
| Factores de riesgo mayor (riesgo relativo 5-20) |
*Cirugía |
|
|---|---|---|
| *Obstetricia |
|
|
| *Problemas de extremidades inferiores |
|
|
| *Neoplasias |
|
|
| *Morbilidad reducida |
|
|
| *Miscelánea |
|
|
| Factores de riesgo menor (riesgo relativo 2-4) |
*Cardiovasculares |
|
| *Estrógenos |
|
|
| *Miscelánea |
|
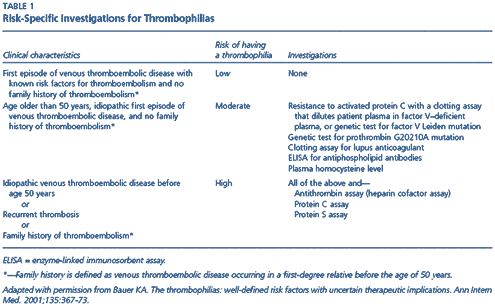
La detección de trastornos de la coagulación hereditarios o adquiridos no está normalmente indicada. Son causas de trombofilia primaria o congénita: resistencia a la proteína C activada por mutación del factor V de Leyden, mutación del gen de la protrombina en la posición 2010, déficit de antitrombina III, déficit de proteína C, déficit de proteína S, y disfibrinogenemia (raro). A ellas habría que añadir el síndrome antifosfolípido y la hiperhomocisteinemia. Además, durante los últimos años, se han publicado algunos trabajos que observan que la Lipoproteína A puede ser un factor de riesgo independiente para el desarrollo de ETV y otros que apreciaron que el genotipo D/D de la ECA protege del riesgo de ETV idiopática (el gen de la ECA presenta un polimorfismo que depende de la inserción «I» o deleción: «D» de un fragmento de 287 pares de bases del intrón 16, lo cual produce tres distintos genotipos: D/D, I/D e I/I). Sólo se aconseja iniciar un estudio de hipercoagulabilidad en los siguientes casos: TVP en pacientes < 50 años (especialmente sin desencadenante claro); TVP recurrente; TVP masiva; TVP en zonas poco habituales; antecedentes familiares de TVP; TVP neonatal; abortos no explicados; trombosis arterial en < 30 años. Los niveles de antitrombina III, proteína C y proteína S, se alteran en la fase de trombosis aguda y también por el uso de anticoagulantes. La valoración de defectos congénitos debe realizarse, por tanto, al menos 15 días después de suspendido el tratamiento anticoagulante y evitando embarazo, tratamiento anticonceptivo y tratamiento hormonal sustitutivo.
La mayoría de los trombos venosos parecen originarse por la agregación de plaquetas en la región de una válvula venosa. Ello inicia la cascada de coagulación resultando en la rápida formación de un trombo. La acción del sistema fibrinolítico intrínseco, cuya secuencia se completa en 7 -10 días, tiende normalmente a resolver el trombo y, si este mecanismo falla, se produce una «organización» del mismo que lo incorpora a la pared venosa, restaurándose la continuidad de la íntima al crearse una nueva capa endotelial que termina recubriéndolo. Desafortunadamente, este proceso puede dañar las válvulas venosas y ocasionar una futura incompetencia de las mismas.
1.2. Repercusiones inmediatas del TP.
1.2.1. Repercusiones respiratorias.
El hallazgo más frecuente y característico de los pacientes con TP es la hipoxemia. Su causa primaria es una alteración de la relación ventilación/perfusión (V/Q). Inicialmente, se crean zonas en las que existe una ausencia de perfusión, predominando unidades con alta relación V/Q (regiones de espacio muerto). La desviación del flujo desde estas unidades no perfundidas a otras permeables favorece la creación de regiones sobreperfundidas (baja relación V/Q), que son las responsables de la hipoxemia inicial.
Hay dos circunstancias que pueden modular el impacto de estas alteraciones en la relación V/Q sobre la oxigenación:
- hiperventilación: puede reequilibrar el cociente V/Q disminuído en la región sana sobreperfundida mejorando el intercambio gaseoso; sin embargo, ello implica un alto coste energético que puede llegar a ser perjudicial.
- saturación venosa mixta de O2 (SvO2): es un reflejo indirecto del gasto cardíaco y se encuentra disminuída en pacientes con TP masivo, en los que la extracción tisular de O2 es muy alta. La baja SvO2 puede influir negativamente en el intercambio gaseoso de un pulmón con regiones de baja relación V/Q.
1.2.2. Repercusiones hemodinámicas.
El TP conlleva un incremento de las resistencias vasculares pulmonares debido a la obstrucción causada por el émbolo y a la vasoconstricción arterial pulmonar motivada por la liberación de sustancias vasoactivas. Este incremento de la presión arterial pulmonar produce una sobrecarga de las cavidades derechas. En embolismos masivos, o si el estado cardiopulmonar previo está alterado, la capacidad de bomba del VD fracasa y provoca una insuficiencia cardíaca.
1.3. Repercusiones «a largo plazo» del TP.
Tal y como ocurre con los trombos venosos, existen dos mecanismos endógenos que actúan sobre el émbolo pulmonar: fibrinolisis y organización. Datos obtenidos de estudios de seguimiento de pacientes con TP empleando gammagrafía de perfusión, confirman una sustancial reducción del territorio no perfundido en escasos días, proceso que suele completarse en 4-6 semanas(1). Sin embargo, un estudio español(2) demuestra persistencia de los defectos de perfusión en el 21 % de los pacientes al cabo de 6 meses, datos similares a los obtenidos por otros investigadores. Este hecho tiene una implicación clínica que no es completamente conocida. En teoría, la persistencia de defectos de perfusión podría ocasionar una hipertensión pulmonar crónica, pero según Riedel(3), esta hipertensión pulmonar postembólica no se desarrollaría tras un episodio de TP único y aislado, sería infrecuente en el TP recurrente o subagudo y más común en el oculto repetido. Por otra parte, el estudio de Carson et al(4) concluye que el TP correctamente diagnosticado y tratado no suele ser causa de muerte a largo plazo. En definitiva, los datos disponibles indican que la hipertensión pulmonar crónica secundaria a TP ocurre en una minoría de pacientes supervivientes del episodio agudo y que este bajo porcentaje no justifica un tratamiento fibrinolítico generalizado. El pronóstico clínico del TEP será abordado en un apartado posterior.
